Filtro de Questões
Abrir Opções Avançadas
Uma solução saturada de $Ag_3PO_4$, a $25 ^\circ\text{C}$, contém 1,2 miligramas desse sal por litro de solução. Assinale a alternativa que apresenta, respectivamente, as concentrações, em $\text{mol}\cdot \text{L}^{-1}$, dos íons $Ag^+$ e $PO^{3-}_4$ e o valor da constante produto de solubilidade $(Kps)$ do $Ag_3PO_4$.
Massas molares: $Ag=107,9\ \text{g}\cdot \text{mol}^{-1};\ P=31,0\ \text{g}\cdot \text{mol}^{-1};\ O=16,0\ \text{g}\cdot \text{mol}^{-1}$.
$10,00\ \text{mL}$ de uma solução de ${\left(NH_4\right)}_2SO_4$ foram tratados com excesso de $NaOH$. O gás $NH_3$ liberado foi absorvido em $50,00\ \text{mL}$ de uma solução $0,10\ \text{mol}\cdot \text{L}^{-1}$ de $HC\ell$. O $HC\ell$ que sobrou foi neutralizado por $21,50\ \text{mL}$ de uma solução $0,10\ \text{mol}\cdot \text{L}^{-1}$ de $NaOH$. Qual a concentração da solução de ${\left(NH_4\right)}_2SO_4$ em $\text{mol}\cdot \text{L}^{-1}$?
O gráfico a seguir corresponde à tendência da primeira energia de ionização em função do número atômico do elemento, do hidrogênio $\left(Z=1\right)$ ao radônio $\left(Z=86\right)$. A energia de ionização corresponde à energia necessária para remover um elétron do átomo neutro.
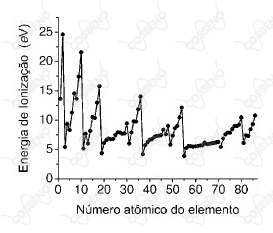
Acerca do tema, considere as afirmativas a seguir:
1. A energia de ionização tende a diminuir no grupo e aumentar no período.
2. A energia de ionização do hidrogênio é maior que a do hélio.
3. A energia de ionização do flúor é maior que a do argônio, do criptônio e do xenônio.
4. As energias de ionização dos elementos do grupo 18 (gases nobres) são inferiores às energias de ionização dos metais de transição.
Assinale a alternativa correta.
Num experimento demonstrativo, foi realizada a queima de um fio de magnésio, reação que libera grande quantidade de calor e luz. Um aluno tomou nota de alguns dados. Examinou o fio de magnésio utilizado, constatando que pesava $2,43\ \text{g}$. Além disso, procurou numa tabela e anotou a densidade do magnésio $\left(d=1,74\ \text{g}\cdot \text{cm}^{-3}\right)$. Após a queima do fio de magnésio, sobraram cinzas que o aluno recolheu e pesou, obtendo o valor de $4,03\ \text{g}$. Compactando-as em um canudo, o volume das cinzas foi estimado em $1,1\ \text{cm}^3$. A partir dos dados anotados pelo aluno, é correto concluir:
Segundo o modelo atômico de Niels Bohr, proposto em 1913, é correto afirmar:
Carregando...