ITA 1991 Química - Questões
Abrir Opções Avançadas
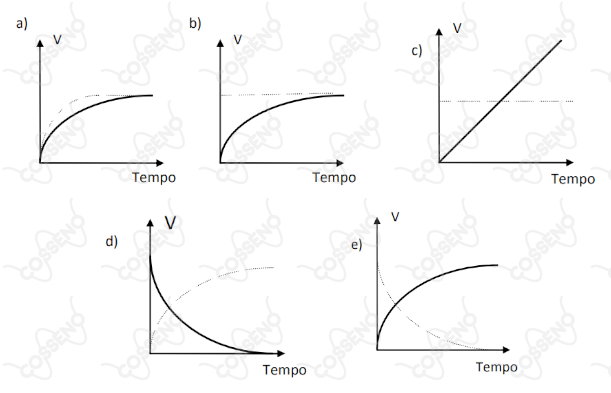
Um balão fechado, previamente evacuado, contém uma ampola cheia de água. Quebrando-se a ampola, nota-se que no equilíbrio ainda sobra água líquida. O sistema é mantido na temperatura ambiente constante. Assinale a opção que mostra, corretamente, como variam com o tempo $(t)$ as taxas $(V)$ de evaporação (linha tracejada) e de condensação (linha cheia). Estas taxas são expressas em quantidade de substância que passa de uma fase para outra, por unidade de tempo e por unidade de área de contato entre as duas fases.
Considere as seguintes soluções diluídas:
I - $x\ mol$ de sacarose / quilograma de água.
II - $y\ mol$ de cloreto de sódio / quilograma de água.
III - $z\ mol$ de sulfato de magnésio / quilograma de água.
IV - $w\ mol$ de cloreto de magnésio/ quilograma de água.
Para que nestas quatro soluções, durante o resfriamento, possa começar a aparecer gelo na mesma temperatura, digamos a $-1,3^{\circ} C$, é necessário que, em primeira aproximação, tenhamos:
Em relação à molécula esquematizada abaixo, são feitas as seguintes afirmações:
$$\ce{\substack{\ce{H}}}-\ce{\substack{\\\\ C\\|\\H}}=\ce{\substack{\\\\ C\\|\\H}}-\ce{\substack{H\\|\\C\\|\\H}}-\substack{\ce{H}}$$
I - Entre os átomos de carbono 1 e 2 existe uma ligação sigma.
II - Entre os átomos de carbono 1 e 2 existe uma ligação pi.
III - Entre os átomos de carbono 1 e 2 existe duas ligações sigma.
IV - Entre os átomos de carbono 1 e 2 existem duas ligações pi.
V - Todas as ligações entre os átomos de carbono e hidrogênio são ligações sigma.
Dentre as afirmações feitas estão corretas apenas:
Um recipiente de aço de volume $V_1$, contém ar comprimido na pressão $P_1$. Um segundo recipiente de aço de volume $V_2$, contém ar menos comprimido na pressão $P_2$. Ambos os cilindros estão na mesma temperatura ambiente. Caso sejam interligados por uma tubulação de volume desprezível, a pressão final em ambos os cilindros será igual a:
Em $1{,}0$ litro de uma solução aquosa não tamponada, a $25\ ^\circ\text{C}$, ocorre uma reação química que produz ânion $\ce{OH-}$. Sabendo-se que ao se iniciar a reação a solução tinha $\text{pH}=6$, após a produção de $1{,}0 \cdot 10^{-3}\text{ mol}$ de $\ce{OH-}$ o $\text{pH}$ da solução será:
Carregando...