IME 2021 Química - Questões
Abrir Opções Avançadas
Considere
Substância | Energia Livre de Gibbs padrão de Formação ($kJ. mol^{-1}$), a $25^{\circ}C$ |
|---|---|
Benzeno (líquido) | $+124$ |
Benzeno (gasoso) | $+129$ |
A pressão de vapor do benzeno em $atm$, a temperatura de $298 \ K$, é aproximadamente:
Estabeleça a relação entre as estruturas de cada par abaixo, identificando-as como enantiômeros diastereoisômeros, isômeros constitucionais ou representações diferentes de um mesmo composto
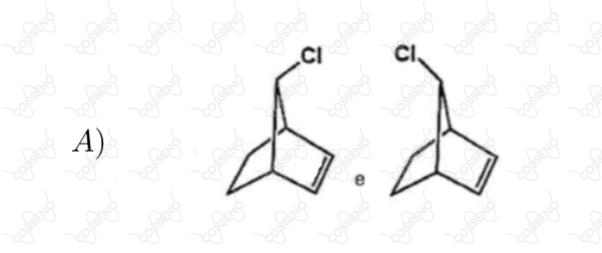
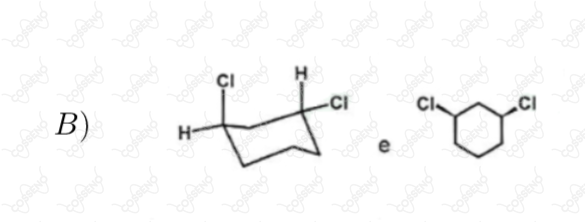
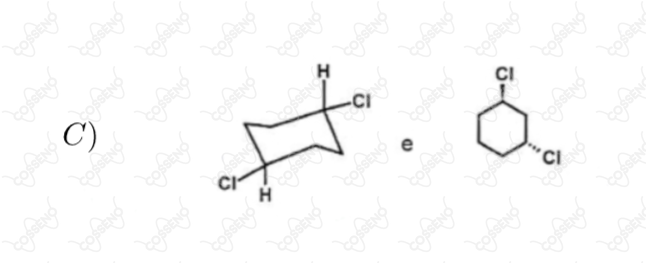

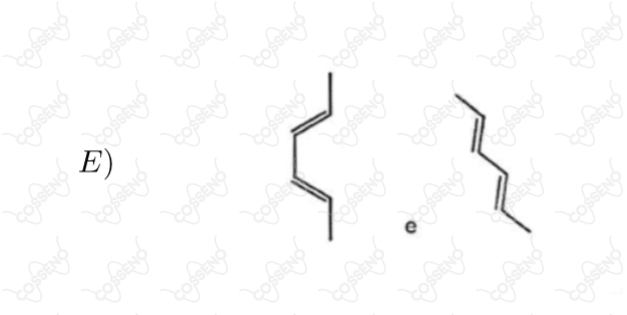
Seja a reação $\ce{A_{(g)} \xrightleftharpoons {} 2B_{(g)}}$, a $298 \ K$ e $1 \ atm$, com $\Delta{G^{0}_{r}} = 0$, sendo $A$ e $B$ gases ideais. Considere as seguintes afirmativas.
No equilíbrio, o valor da pressão parcial de $A$ é igual ao quadrado do valor da pressão parcial de $B$, para qualquer temperatura
Um aumento na pressão parcial de $A$, a partir da situação de equilíbrio, causará o deslocamento da reação para a direita
Se a reação direta for exotérmica, um aumento da temperatura da reação, favorecerá a formação de produto
Está(ão) correta(s) a(s) afirmativa(s):
Um cientista prepara uma amostra de $1, 1 \ g$ do isótopo $\ce{C_{11}}$ do carbono de extrema pureza. Esse isótopo é radioativo, iniciando seu decaimento após a preparação (instante inicial $t_0 = 0$). Sabendo-se que sua meia-vida é de $21$ min, calcule a massa restante de $\ce{C_{11}}$ no instante $t = 1$h e $31$ min
Uma solução de $\ce{Ba{(OH)}_{2}}$ foi adicionada a $300 \ cm^3$ de uma solução $0,5 \ M$ de $\ce{HNO_3}$. Houve a precipitação de um sal, mas o meio permaneceu ácido. Conseguiu-se a neutralização por meio da adição de $200 \ cm^3$ de uma solução $0,25 \ M$ de $\ce{KOH}$, que foi totalmente consumido.
Assim pode-se afirmar que a massa, em gramas, de $\ce{Ba{(OH)}_2}$ presente na solução adicionada era aproximadamente:
Carregando...