IME 2002 Química - Questões
Abrir Opções Avançadas
Apresente as fórmulas eletrônicas e estruturais do trióxido de enxofre, do hidróxido de sódio e perclorato de cálcio.
Uma solução foi preparada dissolvendo-se $2{,}76 \ g$ de um álcool puro em $100{,}00 \ g$ de acetona. O ponto de ebulição da acetona pura é $56{,}13 \ ^{\circ} X$. Determine:
a) O peso molecular do álcool;
b) A fórmula molecular do álcool.
Considere a seguinte reação:
$2 \text{A} +\text{B} \rightarrow \text{C}$
A partir dos dados fornecidos na tabela abaixo, calcule a constante de velocidade da reação e o valor da concentração $X$. Considere que as ordens de reação em relação aos reagentes são iguais aos respectivos coeficientes estequiométricos.
Teste | Concentração de $A \ mol \ / \ L$ | Concentração de $B \ mol \ / \ L$ | Velocidade de reação $mol \ / L / \cdot s$ |
1 | $10$ | $X$ | $v$ |
2 | $X$ | $20$ | $2 \ v$ |
3 | $15$ | $30$ | $13{,}500$ |
Um mol de ácido acético é adicionado a um mol de álcool etílico. Estabelecido o equilíbrio, $50%$ do ácido é esterificado. Calcule o número de mols de éster quando um novo equilíbrio for alcançado, após a adição de $44 \ g$ de acetato de etila.
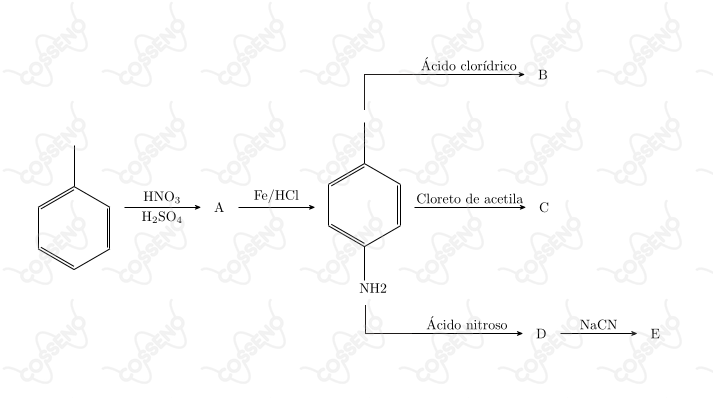
Determine, na sequência de reações abaixo, os principais produtos (A, B, C, D e E) em cada caso.
Carregando...