IME 1998 Química - Questões
Abrir Opções Avançadas
A magnetita é um minério formado em sua maior parte por óxido misto de ferro ($\ce{Fe3O4}$). Ao fazer o tratamento de $100,0g$ de uma amostra do minério, com ácido sulfúrico, obtém-se $29,5g$ de água. Determine:
a) Quais as equações químicas balanceadas que representam o tratamento;
b) Qual a pureza do minério;
c) Quantos gramas de ácido sulfúrico reagiram com o óxido misto.
Massas atômicas:
$\ce{H}=1 u.m.a.$
$\ce{O}=16 u.m.a.$
$\ce{S}= 32 u.m.a.$
$\ce{Fe}=56 u.m.a.$
A lei de periodicidade (ou Lei de Moseley) diz que muitas propriedades físicas e químicas dos elementos são funções periódicas dos seus números atômicos. Há, contudo, algumas propriedades cujos valores só aumentam ou só diminuem com o número atômico e que são chamadas propriedades aperiódicas. Cite duas propriedades aperiódicas dos elementos da tabela periódica e indique como as mesmas variam com o aumento do número atômico.
Uma solução com $102,6g$ de sacarose ($\ce{C12H22O11}$) em água apresenta concentração de $1,2$ molar e densidade $1,0104 g/cm^3$. Os diagramas de fase dessa solução e da água pura estão representados abaixo.
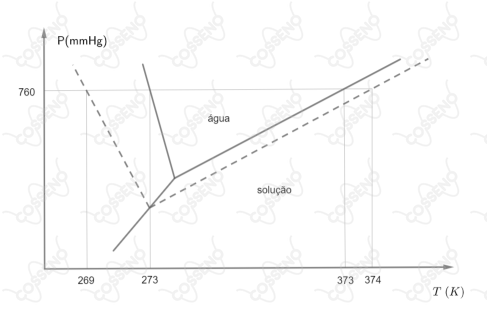
Com base nos efeitos coligativos observados nesses diagramas, calcule as constantes molal ebuliométrica ($K_e$) e criométrica ($K_c$) da água.
Massas atômicas:
$\ce{H}=1 u.m.a.$
$\ce{C}=12u.m.a.$
$\ce{O}=16u.m.a.$
A eletrólise de uma solução aquosa gera uma mistura gasosa hidrogênio-oxigênio para alimentar um maçarico. A mistura gasosa é armazenada em um recipiente com volume constante e igual $500 cm^3$ e o ar contido inicialmente no recipiente é totalmente removido antes de se iniciar a eletrólise. Por medida de segurança, o maçarico só pode ser operado quando a pressão no recipiente for de pelo menos $1,2 atm$. Sabendo-se que a temperatura é de $27^\circ C$ e que a corrente da eletrólise é de $5A$, determine o tempo para que a pressão no recipiente atinja o valor mínimo de operação.
Constante universal dos gases
$R=0,082 atm\cdot \ell /mol \cdot K$
$1$ Faraday$= 1608 A\cdot min$
Uma determinada quantidade de nitrogênio ($N_2$) ocupa um recipiente com volume de $10$ litros a uma temperatura de $127^\circ C$ e a uma pressão de $4,92 atm$. Adiciona-se ao nitrogênio $9,03 \times 10^{23}$ moléculas de oxigênio ($\ce{O2}$). Sabendo-se que a pressão final de equilíbrio do sistema é de $6,15 atm$, calcule a temperatura final de equilíbrio.
Constante universal dos gases
$R=0,082 atm\cdot \ell /mol\cdot K$
Carregando...