IME 1996 Química - Questões
Abrir Opções Avançadas
O nitrogênio forma cinco diferentes óxidos. A análise centesimal de amostras desses óxidos forneceu os resultados a seguir:
percentagem em peso de nitrogênio | percentagem em peso de oxigênio | |
|---|---|---|
Óxido $1$ | $63{,}63$ | $36{,}37$ |
Óxido $2$ | $46{,}67$ | $53{,}33$ |
Óxido $3$ | $36{,}84$ | $63{,}16$ |
Óxido $4$ | $30{,}44$ | $69{,}56$ |
Óxido $5$ | $25{,}93$ | $74{,}04$ |
Determine, a partir destes dados:
a) a fórmula mínima de cada um
b) a(s) nomenclatura(s) correspondente(s) de cada óxido
São dadas as equações químicas, não ajustadas, a seguir:
$$I)\ \ce{KC\ell O3, + H2SO4 -> HC\ell O4 + C\ell O2 + K2SO4 + H2O}$$$$II)\ \ce{KMnO4 + HC\ell -> KC\ell + MnC\ell_2 + H2O + C\ell_2 }$$
Para cada uma dessas equações, determine:
a) os seus coeficientes, considerando os menores números inteiros possíveis
b) o agente redutor
c) o agente oxidante
A pressão osmótica de uma solução de poliisobutileno sintético em benzeno foi determinada a $25\ ^{\circ}\text{C}$. Uma amostra contendo $0{,}20\ g$ de soluto por $100\ cm^3$ de solução subiu até uma altura de $2{,}4\ mm$ quando foi atingido o equilíbrio osmótico.
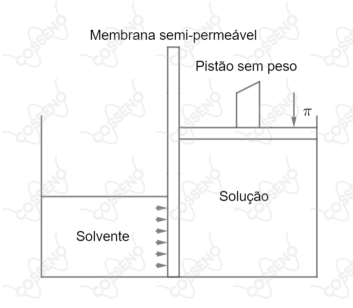
A massa específica da solução no equilíbrio é $0{,}88\ g/cm^3$. Determine o peso molecular do poliisobutileno.
Em duas cubas eletrolíticas, ligadas em série, ocorrem as reações cujas equações são mostradas a seguir, pela passagem de uma corrente elétrica de $1$ Ampère:
$$\text{cuba A:}\quad \ce{Ag+_{(aq)} + e- -> Ag_{(s)}}$$$$\text{cuba B:}\quad \ce{2H+_{(aq)} + 2e- -> H2_{(g)}}$$Pede-se:
a) o tipo de reação que está ocorrendo
b) a denominação do eletrodo onde ocorrem essas reações
c) o tempo necessário para que ocorra a deposição de $1{,}08\ g$ de prata
d) o volume, em litros nas CNTP, do hidrogênio produzido durante o tempo determinado na letra c)
A constante de ionização de um ácido monocarboxílico de massa molecular $60$ é $4{,}0\times 10^{-5}$. Dissolvem-se $6{,}0\ g$ desse ácido em água até completar $1$ litro de solução.
Determine:
a) a concentração de $\ce{H+}$ na solução
b) o $\text{pH}$ da solução
c) a expressão matemática da constante de ionização
d) a concentração de $\ce{H+}$ se o ácido for totalmente dissociado
e) a solução que neutralizará uma maior quantidade de $\ce{NaOH}$, considerando duas soluções, de mesmo volume e de mesmo $\text{pH}$, do ácido monocarboxílico e de $\ce{HC\ell}$.
Carregando...