ESPCEX 2018 Química - Questões
Abrir Opções Avançadas
Quando ocorre a combustão completa de quaisquer hidrocarbonetos, há a produção dos compostos gás carbônico $(\ce{CO2})$ e água $(\ce{H2O})$. Acerca dessas substâncias afirma-se que:
$\text{I}$ – as moléculas $(\ce{CO2})$ e $(\ce{H2O})$ apresentam a mesma geometria molecular.
$\text{II}$ – a temperatura de ebulição da água é maior que a do $(\ce{CO2})$, pois as moléculas de água na fase líquida se unem por ligação de hidrogênio, interação intermolecular extremamente intensa.
$\text{III}$ – a molécula de $(\ce{CO2})$ é polar e a de água é apolar.
$\text{IV}$ – a temperatura de fusão do $(\ce{CO2})$ é maior que a da água, pois, diferentemente da água, a molécula de $(\ce{CO2})$ apresenta fortes interações intermoleculares por apresentar geometria angular.
$\text{V}$ – o número de oxidação (Nox) do carbono na molécula de $(\ce{CO2})$ é +4.
Estão corretas apenas as afirmativas
Os carbetos pertecem aos chamados compostos de transição, isto é, possuem o elemento carbono, mas, devido às suas características, nos carbetos o carbono forma ânions simples que estabelecem ligações com metais ou semimetais. Os carbetos são compostos que apresentam um dos seguintes ânions: metaneto $(\ce{C^{4-}})$ ou acetileto $(\ce{C2^{2-}})$
$\scriptsize{\text{FONSECA, Martha Reis Marques da, Química Geral, São Paulo: Ed FTD, 2007, pág 330}}$
O carbeto de cálcio $(\ce{CaC2})$, também denominado de carbureto ou acetileto de cálcio, é um sólido duro que reage com a água para produção do gás acetileno $(\ce{C2H2})$. A reação que se processa é representada pela seguinte equação não balanceada: $\ce{CaC2 + H2O -> C2H2 + Ca(OH)2 }$.
Com relação a essa reação, seus reagentes e produtos, são feitas as seguintes afirmativas:
$\text{I}$ – o carbeto de cálcio é um composto iônico.
$\text{II}$ – a nomenclatura oficial da União Internacional de Química Pura e Aplicada (IUPAC) para o acetileno (C2H2) é etino.
$\text{III}$ – o Ca(OH)2 é classificado como uma base de Arrhenius e tem nomenclatura de hidróxido de cálcio.
$\text{IV}$ – a soma dos coeficientes da equação corretamente balanceada é 5.
$\text{V}$ – todos os reagentes e produtos são classificados como substâncias simples.
Estão corretas apenas as afirmativas
Na ração operacional do Exército Brasileiro, é fornecida uma cartela contendo cinco comprimidos do composto dicloro isocianurato de sódio, também denominado de dicloro-s-triazinotriona de sódio ou trocloseno de sódio, dentre outros. Essa substância possui a função de desinfecção da água, visando a potabilizá-la. Instruções na embalagem informam que se deve adicionar um comprimido para cada $\pu{1 L}$ água a ser potabilizada, aguardando-se o tempo de $30$ minutos para o consumo. A estrutura do dicloro isocianurato de sódio é representada a seguir:
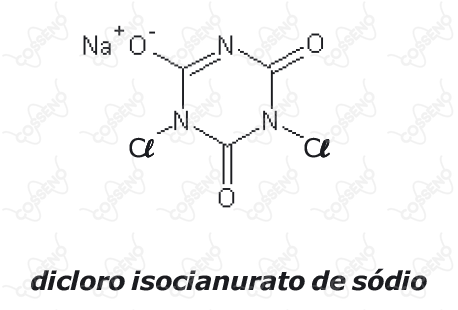
Considerando a estrutura apresentada e o texto, são feitas as seguintes afirmativas:
$\text{I}$ – em sua estrutura encontra-se o grupo funcional representativo da função nitrocomposto.
$\text{II}$ – todos os carbonos apresentados na estrutura possuem hibridização $\ce{sp^2}$.
$\text{III}$ – sua fórmula molecular é $\ce{C3Cl2N3NaO3}$.
$\text{IV}$ – Considerando-se um cantil operacional contendo $\pu{1000 mL}$ de água, será necessário mais que uma unidade do comprimido para desinfecção completa dessa água.
Das afirmativas feitas estão corretas apenas:
A uma solução aquosa de $\pu{100 mL}$ de ácido clorídrico $(\ce{HCl})$ de concentração $\pu{1 mol \cdot L-1}$ foram adicionados $\pu{400 mL}$ de uma solução aquosa de hidróxido de sódio $(\ce{NaOH})$ de concentração $\pu{0,75 mol \cdot L-1}$.
Considerando que:
- a solução básica foi parcialmente neutralizada pela solução do ácido;
- o ácido clorídrico é um ácido forte $(\alpha=100\%)$;
- o hidróxido de sódio é uma base forte $(\alpha=100\%)$.
O pH da mistura resultante dessa reação de neutralização é
A representação a seguir corresponde à parte superior da tabela periódica, na qual as letras não correspondem aos verdadeiros símbolos dos elementos.
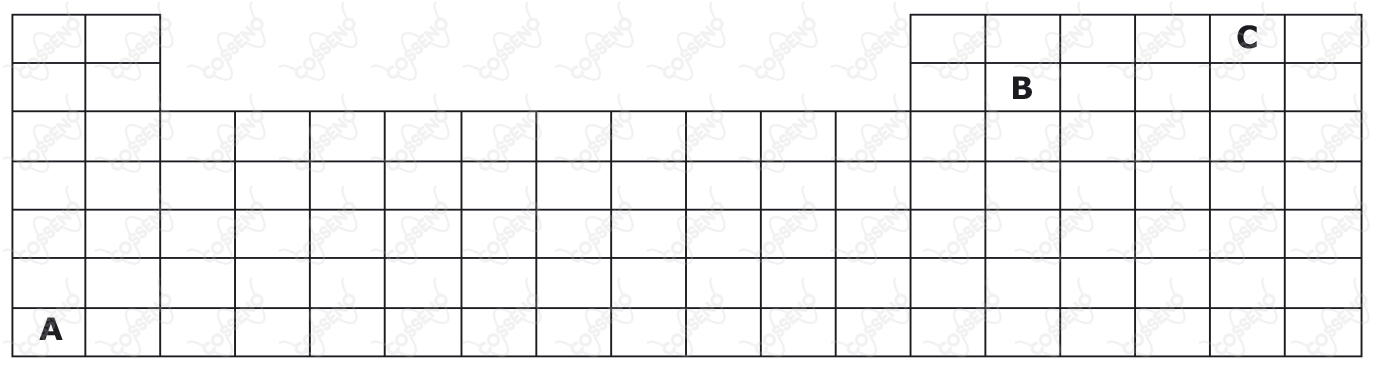
Considere as afirmativas acerca dos elementos hipotéticos $\text{(A, B, C)}$ apresentados na Tabela Periódica.
$\text{I}$ – Dentre os elementos hipotéticos, o elemento A é o de maior afinidade eletrônica (“energia liberada quando um átomo isolado, no estado gasoso, captura um elétron”).
$$ \scriptsize{\text{USBERCO, João e SALVADOR, Edgard. Química, Vol. 2: Físico-Química. 12ª ed.} \\ \text{Reform - São Paulo: Ed. Saraiva, 2009, pág. 202} }$$
$\text{II}$ – Dentre os elementos hipotéticos, pode-se afirmar que o elemento B é o de maior eletropositividade (“capacidade de um átomo perder elétrons, originando cátions”).
$$ \scriptsize{\text{USBERCO, João e SALVADOR, Edgard. Química, Vol. 2: Físico-Química. 12ª ed.} \\ \text{Reform - São Paulo: Ed. Saraiva, 2009, pág. 203}} $$
$\text{III}$ – Dentre os elementos hipotéticos, pode-se afirmar que o elemento C é o mais eletronegativo (“força de atração exercida sobre os elétrons de uma ligação”).
$$ \scriptsize{\text{USBERCO, João e SALVADOR, Edgard. Química, Vol. 2: Físico-Química. 12ª ed.} \\ \text{Reform - São Paulo: Ed. Saraiva, 2009, pág. 202}} $$
Das afirmativas feitas está(ão) correta(s) apenas
Carregando...